诱导性多能干细胞
浏览量: 发布时间:2024-03-14
诱导性多能干细胞(iPS)
背景
诱导多能干细胞(iPS cells)最初是日本人山中申弥(Shinya Yamanaka)于2006年利用病毒载体将四个转录因子(Oct4, Sox2, Klf4 和c-Myc)的组合转入分化的体细胞中,使其重编程而得到的类似胚胎干细胞的一种细胞类型。随后世界各地不同科学家陆续发现其它方法同样也可以制造这种细胞。
iPS细胞研究过程
2006年日本京都大学山中伸弥领导的实验室在世界著名学术杂志《细胞》上率先报道了iPS的研究。
他们把Oct3/4、Sox2、c-Myc和Klf4这四种转录因子引入小鼠胚胎或皮肤纤维母细胞,发现可诱导其发生转化,产生的iPS细胞在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤生成能力、分化能力等都与胚胎干细胞极为相似。
2007年11月,Thompson实验室和山中伸弥实验室几乎同时报道,利用ips技术同样可以诱导人皮肤纤维母细胞成为几乎与胚胎干细胞完全一样的多能干细胞。
所不同的是日本实验室依然采用了用逆转录病毒引入Oct3/4、Sox2、c-Myc和Klf4四种因子组合,而Thompson实验室采用了以慢病毒载体引入Oct4、Sox2加Nanog和LIN28这种因子组合。
2008年,哈佛大学George Daley实验室利用诱导细胞重新编程技术把采自10种不同遗传病患者病人的皮肤细胞转变为iPS,这些细胞将会在建立疾病模型、药物筛选等方面发挥重要作用。
美国科学家还发现,iPS可在适当诱导条件下定向分化,如变成血细胞,再用于治疗疾病。
哈佛大学另一家实验室则发现利用病毒将三种在细胞发育过程中起重要作用的转录因子引入小鼠胰腺外分泌细胞,可以直接使其转变成与干细胞极为相似的细胞,并且可以分泌胰岛素、有效降低血糖。这表明利用诱导重新编程技术可以直接获得某一特定组织细胞,而不必先经过诱导多能干细胞这一步。
2009年,中国科学家于2008年11月利用iPS细胞培育出小鼠—“小小”。
中国科学院动物研究所周琪研究员和上海交通大学医学院曾凡一研究员领导的研究组合作完成的工作表明,利用iPS细胞能够得到成活的具有繁殖能力的小鼠,从而在世界上第一次证明了iPS细胞与胚胎干细胞具有相似的多能性。科学家表示,这一研究成果表明iPS干细胞或许同胚胎干细胞一样可以作为治疗各种疾病的潜在来源。
分化是基因选择性表达的结果,没有改变遗传物质,而重编程在某种意义上就是分化的一个逆转。
与经典的胚胎干细胞技术和体细胞核移植技术不同,诱导多能干细胞技术不使用胚胎细胞或卵细胞,因此没有伦理学问题。此外,利用诱导多能干细胞技术可以用病人自己的体细胞制备专有的干细胞,从而大大降低了免疫排斥反应发生的可能性。
ip细胞建立的简单过程
皮肤细胞或血细胞等组织特异性细胞能够从人体中提取出来,经重编程后返回到一种多能性状态。
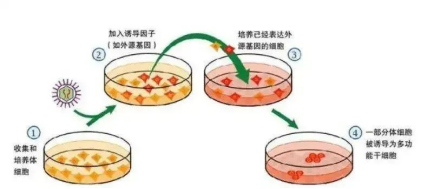
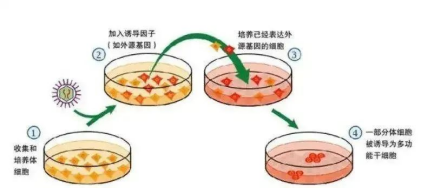
(1)分离和培养宿主细胞,如皮肤细胞。
(2)通过病毒介导或者其他的方式将若干多个多能性相关的转录因子导入宿主细胞。四种特定的转录因子(Oct4, Sox2, Klf4和cMyc)通常用于这种重编程过程中。这些转录因子导致组织特异性细胞关闭它自己的身份和激活多能性细胞的特征。
(3)将病毒感染后的细胞种植于饲养层细胞上,并于ES细胞专用培养体系中培养,同时在培养中根据需要加入相应的小分子物质以促进重编程。重编程为iPS细胞时,关闭了体细胞特异性的表达的基因,开启了使细胞全能性分化的基因。
(4)出现ES样克隆后进行iPS细胞的鉴定,如细胞形态、表观遗传学、体外分化潜能等方面。





