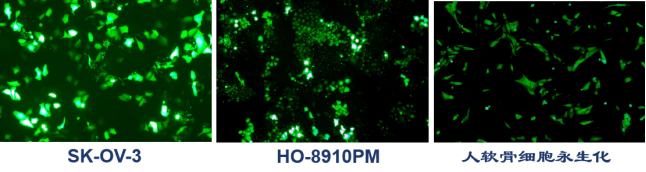
细胞荧光标记
浏览量: 发布时间:2023-03-14
细胞荧光标记
原理
细胞荧光标记是利用荧光蛋白或荧光素酶报告基因作为标志物对研究细胞进行标记的分析方法,常用的荧光蛋白为绿色荧光蛋白(GFP)和红色荧光蛋白(RFP)两种。这些标志物通过转基因技术构建到载体上,可跟踪和判断生物细胞的分子变化。
方法
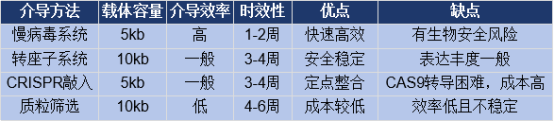
慢病毒构建稳转细胞系是目前最常规的稳转株构建方法,可以介导shRNA,过表达,CrispR,报告基因等等基因转导的需求,一般情况下经过1-2周的筛选,细胞即可实现稳转。
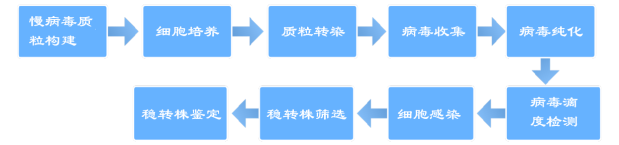
慢病毒转染步骤
稳转株的构建
1、目的细胞病毒感染
处于对数生长期的细胞胰酶消化,完全培养基制成 3-5×104个/mL细胞悬液,并根据表1接种相应的细胞数到培养板中,继续培养保证感染时铺板量达到15-30%左右,按照预实验结果,参考表1更换感染培养基,加入最适病毒量进行感染。参照预实验结果,选择感染后最适时间点更换为常规培养基继续培养,一般为感染后8-16h左右。

表1.贴壁细胞接种和病毒感染时的体积
按照预实验确定的感染条件,使用感染液将细胞制成 3-5×105个/mL悬液,并根据表2接种相应的细胞数到培养板中。铺板后无需培养,参照预实验确定的 MOI 加入最适病毒量感染。参照预实验结果,选择感染后最适时间点,一般为 8-16h 左右,将各孔中细胞收集到干净的 1.5 ml EP 管中,以 1300 rpm 离心 2 min,去掉上清液,更换为完全培养基,轻轻混匀后放回培养板中继续培养。

表2.悬浮细胞接种体积
2、感染后细胞加入抗生素筛选
1)感染 72h 后,观察细胞状态和感染效率。要求细胞状态良好,未出现大量死亡现象,特别是保证 NC 组与 CON 组细胞状态相当。
2)加入合适浓度的抗生素,筛选至少 48h。如病毒载体带有荧光标记,荧光效率需要达到 100%后,降低抗生素维持浓度(相较之前的药筛浓度,浓度减至之前浓度的 1/2~1/4 或更低)继续对感染后的细胞进行筛选和扩增,同时收集细胞进行下游 qPCR 检测(鉴定目的基因表达水平)。
3、细胞扩增、冻存、复检
1)将加入抗生素维持浓度的细胞继续进行扩增。待 qPCR 检测结果合格后进行冻存,保证每株细胞至少冻存 6 支。
2)冻存2-3天后,任意复苏一支,判断复苏细胞状态。
示例