实时荧光定量PCR检测
浏览量: 发布时间:2023-03-14
实时荧光定量PCR检测
简介
Real-time PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值和标准曲线的分析对起始模板进行定量分析。
实时荧光定量PCR技术具有特异性强,有效解决了PCR污染问题、自动化程度高等特点,做到PCR每循环一次就收集一个数据,建立实时扩增曲线,准确地确定Ct值,从而根据Ct值确定起始DNA拷贝数,做到了真正意义上的DNA定量。
类型
1、SYBR Green Ⅰ染料法
原理:在PCR反应体系中加入荧光染料,DNA扩增过程中,荧光染料特异性地掺入DNA双链发射荧光信号,随着反应的进行荧光强度逐渐增强,从而实现实时测量。
优点:
(1)成本较低,适合样本数较多的实验。
(2)在实验设计阶段较省时,只需设计配对的引物。
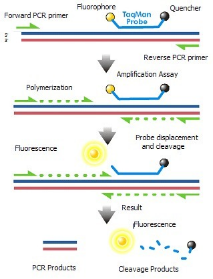
2、TaqMan探针法
原理:在探针的5’端设计有报告基团,3’端设计有淬灭基团,当报告基团接近淬灭基团时,不会检测到荧光信号。qPCR反应时,寡核苷酸两个基团分离,即可检测到荧光信号,并与PCR产物同步。
优点:
(1)引物和探针的结合特异性更高,数据更可靠。
(2)数据分析较为简便。
步骤
1、样本准备
从待测样本中提取DNA或RNA。
2、引物和探针设计
在 NCBI数据库中找到目标基因的序列以及位点,用primer primer 5或其他软件设计适当的引物和探针,用于特异性的扩增目标序列。一般在设计引物时,GC含量控制在40%-75%之间,引物的TM值比探针的小5-10℃。
3、PCR反应
将样本与引、探针一起加入带有DNA聚合酶的反应体系中,进行PCR扩增。PCR反应温度循环包括三个阶段:变性、退火、延申。在变性阶段,DNA双链会通过高温变成两条单链。退火时,引物、探针与目标序列互补配对。延申时,DNA聚合酶会合成新的DNA双链,此时,也会将与目标序列上互补配对的探针打掉,使探针上的荧光基团与猝灭基团分开,释放出荧光信号。
4、荧光信号检测
在PCR反应过程中,实时荧光检测仪会定期检测PCR管中的荧光信号。
5、数据分析
通过实时荧光收集到的信号,仪器会自动绘制荧光曲线,通常5-15个循环的荧光信号都属于背景信号,然后将其设置为扩增曲线的背景或基线。在理想条件下,PCR产物量呈指数倍增长Yn=Y0×2^n(X0:初始模板量,n:PCR循环次数,Yn:第n次循环后的产物量)。但实际上可能引物模板引物消耗完,DNA聚合酶逐渐失活等原因,产物量就恒定。荧光强度就呈“S型”曲线即“扩增曲线(Amplication plot)”,分为四个时期:基线期、指数扩增期、线性增长期、平台期。再根据待测样品的Ct,可计算样品拷贝数/浓度。通常模板每稀释10倍,CT值增大3.33。如果研究基因表达量通过比较达到设定荧光阈值所需的Ct值大小,可以比较出基因表达量的高低。
检测内容
1. 细胞/组织的基因差异表达检测,经过不同处理样本之间特定基因的表达差异(如药物处理、物理处理、化学处理等),特定基因在不同时段的表达差异以及cDNA芯片或差显结果的确证。
2. 组织/细胞样品中基因拷贝数的确定,DNA或RNA的相对和绝对定量分析。包括病原微生物或病毒含量的检测,转基因动植物转基因拷贝数的检测,RNAi基因失活率的检测等。
3. 基因分型,基因突变及多态性方面的研究。





